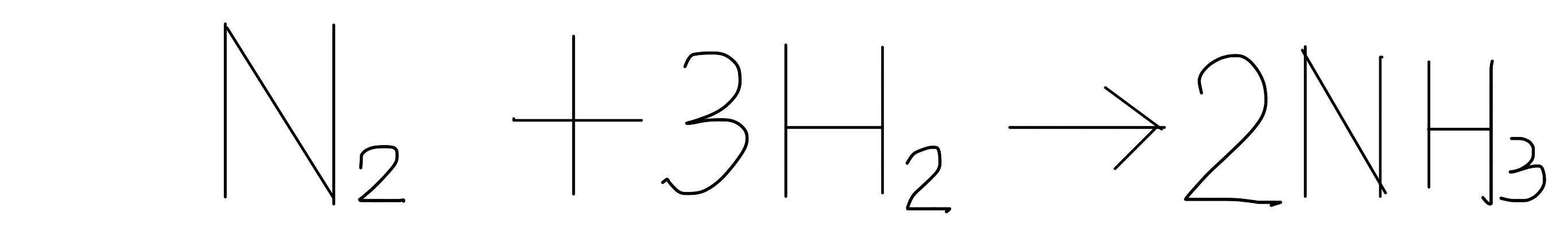
酸鹼鹽
Acid and Base
酸鹼性是使用物體品嘗起來的味道來決定的嗎?還是要透過什麼化學儀器或方式得知呢?讓我們一起探索!

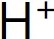 稱為酸。
稱為酸。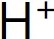 者,稱為強酸;反之則為弱酸。
者,稱為強酸;反之則為弱酸。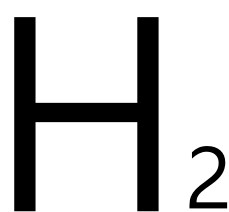 。
。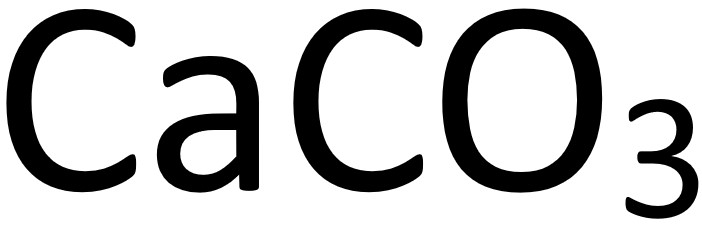 :大理石、灰石、方解石)會產生二氧化碳
:大理石、灰石、方解石)會產生二氧化碳 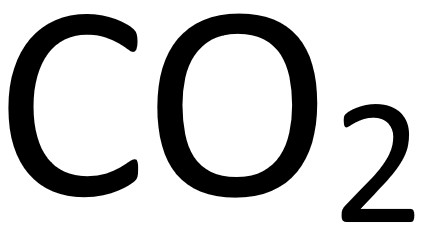 。
。(1)無色、具刺激(2)蒸發到空氣中的HCl分子與空氣中的水蒸氣結合成的酸霧刺鼻,會傷害人體器官及黏膜。註:工業用含鐵離子因此呈淡黃色。
 ):強酸
):強酸(1)無色液體,會腐蝕皮膚(2)受光照射會產生紅棕色有毒的二氧化氮--->以深色玻璃瓶盛裝
(3)用途:肥料、炸藥TNT(國防工業之母)
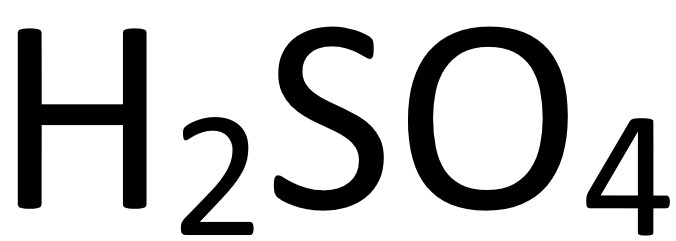 ):強酸
):強酸(1)沸點在攝氏300度以上註:可用以製造其他酸
(2)腐蝕性極強,具強烈脫水性,可讓蔗糖等碳水化合物脫水(3)密度比水大,因此稀釋濃硫酸應將硫酸緩緩加入水中(4)用途:鉛蓄電池、製造醫藥、染料、衣料、造紙
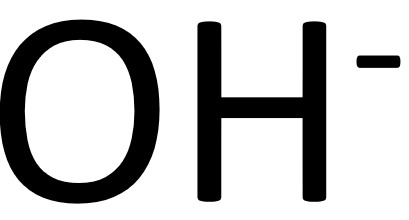 稱為鹼。
稱為鹼。 者,稱為強鹼;反之則為弱鹼。
者,稱為強鹼;反之則為弱鹼。(1)白色固體,具腐蝕性,溶於水中會放熱。(2)易吸收水氣和二氧化碳變質(潮解)--->需密封保存(3)用途:肥皂、人造絲
(1)白色粉末(2)易吸收空氣中水蒸氣--->乾燥劑(3)氧化鈣溶於水中,形成氫氧化鈣(俗稱熟石灰、石灰水)--->檢驗二氧化碳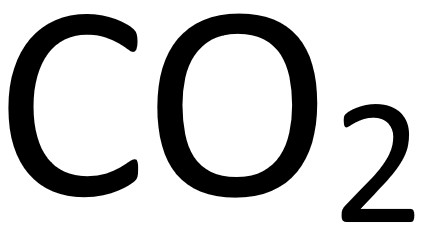
*註:澄清石灰水遇二氧化碳會形成碳酸鈣而變白色混濁
(4)用途:檳榔添加物(石灰CaO)
 )(俗稱:阿摩尼亞):弱鹼
)(俗稱:阿摩尼亞):弱鹼(1)無色、具臭味、易溶於水且比空氣輕的氣體註:HCl和 會反應形成白色煙霧狀氯化銨
微粒
(2)用途:製造肥料、稀釋後可做為清潔用途註:哈柏法製氨